PARTICULARIDADES BIOLÓGICAS Y CONTROL CON EXTRACTOS VEGETALES DE Spodoptera frugiperda (J.E.SMITH) EN EL CULTIVO DEL MAÍZ
BIOLOGICAL PARTICULARITIES AND CONTROL WITH VEGETABLE EXTRACTS of Spodoptera frugiperda (J.E.SMITH) IN THE CULTURE OF CORN
Autores: Noila Soto Domínguez1
Yoel Viña Cepero2
Miguel Angel Iparraguirre Cruz3
Miladys Cedeño Ríos4
Jessica Raimundo Da Silva Cardoso5
Institución: 1,3,4,5 Universidad de Ciego de Ávila Máximo Gómez Báez, Cuba
2Departamento Provincial de Sanidad Vegetal, Cuba
Correo electrónico: 1noila@unica.cu
|
Soto, N.; Viña, Y.; Iparraguirre, M.A.; Cedeño, M. & Da Silva, J. Particularidades biológicas y control con extractos vegetales … Pág. 13-23 Recibido: 21/02/2021 Aceptado: 20/06/2021 Publicado: 15/09/2021 |
Universidad&Ciencia Vol. 10, No. 3, septiembre-diciembre (2021) ISSN: 2227-2690 RNPS: 2450 |
RESUMEN
El experimento se desarrolló en el Laboratorio de Entomología de la Facultad de Ciencias Agropecuarias de la Universidad Máximo Gómez Báez de Ciego de Ávila durante los años 2017 y 2019. El objetivo de nuestro trabajo es determinar las particularidades biológicas de Spodoptera frugiperda (J.E.Smith) y los extractos vegetales más efectivos para su control. Se determinaron las particularidades biológicas de Spodoptera frugiperda (J.E.Smith) según las metodologías de Gómez Souza, et al.(1990), Fumero, et al.(2004), Armas y Ayala, (1990) e Iparraguirre, (1998). El ciclo de vida de S. frugiperda se desarrolló en 28.5 días como promedio con una temperatura entre los 25 y 30 grados centígrados. Se probaron los extractos de Moringa masa fresca, Moringa masa seca ,Tithonia masa seca y de Tithonia masa fresca de 1:3 de concentración etanoica siendo a los 3 días la Moringa masa fresca en ambos casos la más efectiva logrando una mortalidad del 66,66 % seguido de la Moringa masa seca, Tithonia masa fresca que lograran un 55,55 % mostrando diferencia significativa. Posterior a los 3 días los extractos Tithonia masa fresca, Moringa masa fresca y Tithonia masa seca mostraron un excelente efecto residual en el control de Spodoptera frugiperda J.E.Smith pues lograron una mortalidad de 100, 88,88 y 66,66 % respectivamente.
Palabras clave: Ciclo de vida, Mortalidad, Moringa, Palomilla, Tithonia.
ABSTRACT
The experiment was developed in the Entomology Laboratory of the Faculty of Agricultural Sciences of the Máximo Gómez Báez University of Ciego de Ávila during the years 2017 and 2019. The objective of our work is to determine the biological peculiarities of Spodoptera frugiperda (J.E.Smith) and the most effective plant extracts for its control. The biological peculiarities of Spodoptera frugiperda (J.E.Smith) were determined according to the methodologies of Gómez Souza, et al. (1990), Fumero, et al. (2004), Armas y Ayala, (1990) and Iparraguirre, (1998). Life cycle of S. frugiperda developed in 28.5 days on average with a temperature between 25 and 30 degrees centigrade. Moringa fresh mass, Moringa dry mass, Tithonia dry mass and Tithonia fresh mass extracts of 1: 3 ethanoic concentration were tested, being the Moringa fresh mass in both cases the most effective after 3 days, achieving a mortality of 66.66 % followed by Moringa dry mass, Tithonia fresh mass that achieved 55.55 % showing significant difference. After 3 days, the extracts Tithonia mass fresh, Moringa mass fresh and Tithonia mass dry showed an excellent residual effect in the control of Spodoptera frugiperda J.E.Smith as they achieved a mortality of 100, 88.88 and 66.66 % respectively.
Keywords: Life cycle, Moth, Mortality, Moringa, Tithonia.
INTRODUCCIÓN
En Cuba, el maíz reviste una gran importancia y, en la actualidad, las necesidades internas de dicho grano no se satisfacen ni un mínimo con las producciones nacionales. Una de las razones por las que se obtienen rendimientos bajos y costos de producción altos en este cultivo en Cuba, es la elevada incidencia de organismos nocivos que se convierten en plagas y con frecuencia causan severos daños; la más importante es la Spodoptera frugiperda J.E. Smith la cual para controlarla se incurre en gastos elevados, ya que se basa fundamentalmente en el uso de extractos vegetales con productos químicos sintéticos (Sosa y Vitti, 2005). En la provincia se tiene un solo antecedente del uso de extractos contra Spodoptera frugiperda (J.E.Smith) (paraiso, escoba amarga y la mezcla de los mismos) que alcanzaron una mortalidad de 100 % a los 8 dias. (Gómez Casanova, 2015)
Frente a esta catástrofe se inició la reevaluación del uso conjunto y coordinado de varias técnicas de control, entre ellas el uso de plantas biocidas, dirigidas ya no contra una plaga específica, sino contra el conjunto de problemas sanitarios (Nicholls, 2014). Según lo explicado anteriormente el objetivo de nuestro trabajo es determinar las particularidades biológicas de Spodoptera frugiperda JE Smith y los extractos vegetales más efectivos para su control.
Determinación de las particularidades biológicas de Spodóptera frugiperda (J.E.Smith)
a) Morfología
Se observó con ayuda del estereomicroscopio con un aumento de 40x todos los estados de la plaga, se describieron y con ayuda de la literatura se corroboró lo observado, comparando con los resultados de otros autores.
Determinación de la Mortalidad de Spodoptera frugiperda (J.E.Smith) con respecto al extracto aplicado
a) Recolección de muestras de plantas
El material vegetal se colectó de plantas de Moringa oleifera cv. Supergenius y de Tithonia diversifolia de 5 años de edad y cultivadas en la Estación Experimental Ruta Invasora aeropuerto, en la provincia de Ciego de Ávila. La colecta se realizó en horas tempranas (8:00-10:00 am), las hojas se tomaron de las ramas intermedias del árbol. El material recolectado se tomó considerando el buen estado fitosanitario, sin picaduras de insectos, afectado por enfermedades y libre de contaminaciones abióticas.
b) Métodos de Extracción de los extractos
La metodología utilizada para extracción de los extractos etanoico fue de (Linares Rivero, 2018), que se detalla a continuación:
Para la extracción de masa seca se lavaron las muestras con agua destilada y se secaron en una estufa modelo HS62A a 60°C durante 72 h hasta masa constante. Posteriormente, se trituraron en un molino modelo Mikro-Feinmuhle-Culatti Alemania.
Las extracciones se realizaron a partir
de 1 g del polvo de hojas secas y 1g de hojas frescas se utilizó como solvente
el etanol comercial (95 %) en una proporción 1:30 y 3h como tiempo de
extracción. Se empleó el método de extracción con agitación magnética, este se
realizó con el empleo de un agitador magnético (RETOMED Cuba AM.04). Los
extractos se filtraron con una gasa para separar del residuo vegetal, se
utilizaron tres réplicas para cada extracción. 
Figura 1.Extracción de los extractos
Todo esto fue necesario para conservar las sustancias activas de los tejidos empleados, deshidratándolos de manera natural.
c) Mortalidad de Spodoptera frugiperda (J.E.Smith)
La metodología utilizada durante la investigación fue la de (Gomero, 1994).
Las especies vegetales utilizadas fueron.
Testigo
1- Moringa oleífera masa seca (1g de polvo de hoja y 30 de etanol 95 %)
2- Moringa oleífera masa fresca (1g de hojas y 30 de etanol 95 %)
3- Tithonia diversifolia masa seca (1g de polvo de hojas y 30 de etanol 95 %)
4- Tithonia diversifolia masa fresca (1g de hojas y 30 de etanol 95 %)
Las aplicaciones se efectuaron en forma de inmersión sumergiendo la hoja de maíz en un recipiente que contiene los extractos (según tratamiento) y se pusieron en una habitación ventilada a secar. Inmediatamente después de secarse el extracto sobre la hoja, se colocan las larvas dentro de los tubos de ensayo y se les agregó el alimento, según variante de estudio, tapando la boca de éstos con algodón. El tratamiento se repite 3 veces (por cada extracto). Luego se tomaron los datos correspondientes al primer día, a los 3 días y posterior a los 3 días, haciendo lo mismo en todas las repeticiones. Se evaluaron la cantidad de insectos vivos y muertos.
Posteriormente a los 3 días se comenzaron a alimentar con hojas de maíz sanas y libres de contaminantes, los insectos que quedaron vivos por repetición, se utilizaron para determinar el efecto que realizan los extractos posteriores a los tres días de aplicados.
Para la determinación de la mortalidad (%), se determinaron en cada tratamiento el número de larvas muertas y se dividieron entre el número total de larvas y este resultado se multiplicó por 100.
Los datos obtenidos se transformaron para sus respectivos análisis estadísticos.
RESULTADOS Y DISCUSIÓN
Particularidades Biológicas de Spodoptera frugiperda (J.E.Smith)
a) Morfología
En las observaciones se determinó:
Huevos: son de forma globosa, con estrías radiales, de color rosado pálido que se torna gris a medida que se aproxima la eclosión lo que coincide con León (2016). Las hembras depositan los huevos corrientemente durante las primeras horas de la noche, tanto en el haz como en el envés de las hojas, las puestas se realizan en grandes grupos que pueden llegar a alcanzar hasta miles de huevos, cubiertas por segregaciones del aparato bucal y escamas de su cuerpo (similar a peluda).que sirven como protección contra algunos enemigos naturales o factores ambientales adversos. Este insecto ovoposita generalmente en el envés de las hojas lo cual no se corresponden con las observaciones realizadas por nosotros ya que actualmente se han encontrado las puestas en el haz de las hojas y miden unos 0,3 a 0,4 milímetros (figura 2).


Figura 2. Masa de huevos de Spodoptera frugiperda (Foto tomada en el laboratorio de Entomología de la Facultad de Ciencias Agropecuarias de la Universidad de Ciego de Ávila durante el año 2019.
Larva: Según observaciones realizadas son de color carmelita. Según (Cortés- Mondaca, et al., 2014), (Cortés-Mondaca, 2015), el color de las larvas varía dependiendo de la alimentación) con el cuerpo cilíndrico y dividido por franjas más oscuras, la cabeza es más pequeña que el resto del cuerpo y su color es negro, las más grandes en el último estadio pueden llegar a medir hasta 35 a 40 mm (figura 3) de largo lo cual no coincide con lo planteado con los autores anteriormente mencionados que dicen que la larva pueden llegar a medir 25 a 35mm y 38 a 51mm. Las larvas poseen hábitos caníbales cuando la diferencia de tamaño es muy grande, por lo que no se pueden criar larvas de diferentes estadios en el mismo lugar, lo cual es un aspecto importante a tener en cuenta como hospedante de controles biológicos en las crías de laboratorio lo anterior coincide con (Cortés- Mondaca, et al., 2014). Las larvas neonatales, se alimentan del corion de los huevecillos de donde nacen y después comienzan a alimentarse de las hojas jóvenes de la planta, las mismas que la protegen de factores adversos, en los instares posteriores se alimentan de las estructuras reproductivas, tales como el meristemo de crecimiento (cogollo) o las flores evitando así la competencia por el alimento y el canibalismo (Barros et al., 2010; Hardke et al., 2015, Citados por LEON, et al., 2016).


Figura 3. Larva de Spodoptera frugiperda .Foto tomada en el laboratorio de Entomología de la Facultad de Ciencias Agropecuarias de la Universidad de Ciego de Ávila durante el año 2019
Pupa: es de forma cilíndrica en el centro y enconada en las puntas con un pico mayor en la punta inferior, su color es pardo rojizo coincidiendo con (Cortés-Mondaca, et al., 2014), posee líneas oscuras en forma de círculo por todo su cuerpo, su tamaño varía desde 18 a 21 mm de largo y 5 mm de diámetro según observaciones realizadas en el laboratorio de Entomología de la Facultad de Ciencias Agropecuarias (figura 4) Esto no coincide con (García Nevárez, Tarango y Socorro, 2009) que plantean que la pupa es de color café rojizo y mide entre 14 y 18 mm de longitud.


Figura 4. Pupa de Spodoptera frugiperda (Foto tomada en el laboratorio de Entomología de la Facultad de Ciencias Agropecuarias de la Universidad de Ciego de Ávila durante el año 2019).
Adulto: según observaciones realizadas en el laboratorio de Entomología de la Facultad de Ciencias Agropecuarias son mariposas de pequeño tamaño y presentan dimorfismo sexual, según (Cortés- Mondaca, et al., 2014), aunque a simple vista es difícil diferenciar el macho de la hembra. Los machos tienen expansión alar de 32 a 35 mm; longitud corporal de 20 a 30 mm; las alas anteriores son pardo-grisáceas con algunas pequeñas manchas violáceas con diferente tonalidad, en la región apical de estas se encacha blanquecina notoria, orbicular tiene pequeñas manchas diagonales, una bifurcación poco visible que se extiende a través de la vena costal bajo la mancha reniforme; la línea subterminal parte del margen la cual tiene contrastes gris pardo y gris azulado. Las alas posteriores no presentan tintes ni venación coloreada, es más bien blanquecina, las hembras tienen una expansión alar que va de los 25 a 40 mm, faltándole la marca diagonal prominente en las anteriores que son poca agudas, grisáceas, no presentan contrastes; la mancha orbicular es poco visible; la línea postmedial doble y fácilmente vista (figura 5) coincidiendo con (Ortiz, 2010); que obtuvo resultados similares.


Figura 5. A la izquierda hembra de Spodoptera frugiperda y a la derecha macho.
Mortalidad de Spodoptera frugiperda(J.E.Smith) con respecto al extracto vegetal aplicado
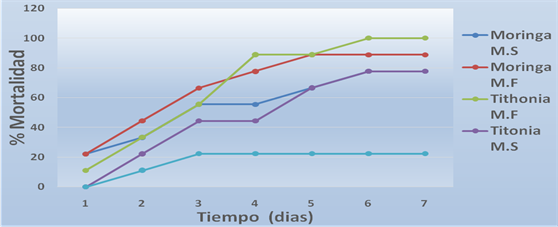
Figura 6. Mortalidad (%) de Spodoptera frugiperda (J.E.Smith) con respecto al extracto vegetal aplicado
Al primer día de aplicados los extractos, los únicos que tuvieron efecto sobre el insecto fueron la Moringa masa seca, masa fresca y Tithonia masa fresca con un porcentaje de mortalidad de 22,22 %, 22.22 % y 11,11 % respectivamente. No obstante, se observó además en todas las variantes poco consumo de las hojas lo que coincide con (Lizarazo H, Mendoza y Carrero, 2008), experimento en el cual se obtuvieron similares resultados, esto demuestra el efecto repelente de estos extractos, coincidiendo con lo planteado por (Gomero, 1994), que obtuvo resultados similares en Perú, no así en el caso de la Tithonia masa seca, la cual no tuvo ningún efecto sobre el insecto.
A los 2 días de aplicados los extractos (figura 6) no se mantiene el mismo resultado porque todos los extractos tienen influencia sobre el insecto y aumentaron su efectividad, el porcentaje de mortalidad de la Moringa masa seca es de 33.33 %, en Moringa masa fresca de 44.44 %, Tithonia masa seca de 22.22 % y Tithonia masa fresca fue de 33.33 %. Se mantiene además el poco consumo de las hojas en todas las variantes. Esto demuestra según (Gomero, 1994) que estos extractos provocan cierta protección de la hoja sin causar la muerte de las larva debido a que las sustancias activas de los extractos reducen la vitalidad en un grado significativo y previenen el daño foliar.
A los 3 días como se observa en (la figura 6) todos los preparados ejercieron cierto control sobre la S. frugiperda, incluso el solvente, lo que parece enmascarar el efecto de las sustancias activas de las plantas, lo que no permite concluir de manera definitiva sobre su eficiencia, por otro lado al comparar los tratamientos con el testigo (con la misma concentración de solvente) se observa una notable diferencia entre el porcentaje de mortalidad de la Moringa masa fresca que obtuvo un porcentaje de mortalidad de 66.66 % que según lo expresado por (Vazquez Moreno, 2003) un preparado biológico se considera efectivo si su porcentaje de mortalidad rebasa el 60 %.
Posterior a los 3 días de aplicados los extractos, al comenzar a dar a los insectos hojas totalmente sanas, sin ningún tipo de contaminante con el objetivo de determinar el efecto residual de los extractos, se obtuvo como resultado que todos tienen un gran efecto residual pues logran una efectividad superior al 60 % con respecto a los insectos que concluyen su ciclo de vida como se observa en la figura 6, Por lo que podemos concluir que los extractos utilizados son promisorios para el control de la Spodoptera frugiperda.
En el caso de los insectos que sobrevivieron al efecto de los extractos y se convirtieron en adultos se les dio seguimiento hasta su muerte y se observó que los mismos no llegaron a ovopositar lo que demuestra una vez más el efecto residual de los extractos aplicados lo cual se observó en los experimentos realizados por (Gómez Ramírez y Soto, 2008) en trabajos realizados con extractos de semillas de anón (Annona squamosa), Neem (Azadirachta indica); hojas de Tabaco (Nicotiana tabacum) pringamosa (Jatrophasp.) y frutos de ají (Capsicum frutescens) que obtuvieron resultados similares en la descendencia.
CONCLUSIONES
Ø Los aspectos morfológicos de Spodoptera frugiperda (J.E.Smith) han sufrido variaciones con respecto al tamaño de la larva y la pupa.
Ø El sitio de ovoposición de Spodoptera frugiperda (J.E.Smith) ha variado del envés al haz de la hoja en la actualidad.
Ø Los extractos Tithonia masa fresca, Moringa masa fresca y Tithonia masa seca son promisorios para el control de Spodoptera frugiperda (J.E.Smith) pues lograron una mortalidad de 100, 88 y 66 % respectivamente.
REFERENCIAS BIBLIOGRÁFICAS
ARMAS, J L y AYALA, L J. (1990). Metodología para la cría continua de Spodoptera frugiperda, J. E. Smith en dieta artificial. pp. 78-85.
CORTÉS- MONDACA, E. …[et al.] (2014). Efectividad de insecticidas novedosos al 100 % y 50 % de la dosis sobre gusano cogollero Spodoptera frugiperda (J.E. Smith) en maíz. pp. 488-492.
CORTÉS-MONDACA, E. (2015). Parasitismo natural de gusano cogollero J. E. Smith en maíz y sorgo, en Sinaloa, México. Entomología Mexicana. Vol. 10 No. 1, pp. 488-492.
FUMERO, M, DÍAZ, J y FERRER, C. (2004). Metodología para la cría masiva de Spodoptera frugiperda, J. E Smith sobre dieta natural. III Congreso Latinoamericano de la Sección Regional Geotrópica de Organizaciones internacionales de Control biológico. La Habana, p. 19.
GARCÍA NEVÁREZ, Gerardo, TARANGO Rivero y SOCORRO Héctor. (2009). Manejo biorracional del gusano cogollero en maíz. La Habana: Instituto Nacional de investigaciones Agrícolas y Pecuarias. pp. 5-24.
GOMERO, O. (1994). Plantas para proteger cultivos. Tecnología para controlar plagas y enfermedades. Lima. Perú. pp. 75-76; 89-91.
GÓMEZ CASANOVA, J.H. (2015). Particularidades y Control Biológico de Spodoptera frugiperda (J.E.Smith) en maíz en la UBPC “Santa Lucia” de Ciego de Ávila. Tesis de Master en Ciencias Agrícolas. Ciego de Ávila. p.39.
GÓMEZ RAMÍREZ, C. y SOTO, G. A. (2008). Productos alternativos para el manejo de Cosmopolites sordidus (COLEÓPTERA: DRYOPHTHORIDAE). España. Universidad de Caldas. pp. 45-50.
GÓMEZ SOUSA, Jorge, PÉREZ, Andreu y FERNÁNDEZ, I. (1990). Manual para la cría y liberación de de Chelonus insularis(CRESS) (Hymenoptera,Bracinidae) y Euplectrus plathypenae (How) (Hymenoptera, Eulophidae) parásitos ovolarval y larval de Spodoptera frugiperda (J.E.Smith). Las Villas MES pp. 4-5.
IPARRAGUIRRE, Miguel Angel. (1998). Nueva opción de control biológico de la Palomilla del maíz en la provincia de Ciego de Ávila. Materiales del forum Tecnológico sobre Manejo integrado de Plagas. Matanzas. pp. 15-17 69-71.
LEÓN, Luis Ricardo, …[et al.] (2016). Extracto clorofórmico de Salvia ballotiflora, una alternativa para el manejo integrado del gusano cogollero del maíz Spodoptera frugiperda J. E. Smith, 1797 (lepidoptera: noctuidae). Querétaro: s.n., Vol. 3. ISSN 2448-475X.
LINARES RIVERO, Claudia. (2018). Obtención de extractos foliares de Moringa oleífera Lam mediante el uso de diferentes métodos de extracción. Protocolo de investigación. Bioplantas. MES.
LIZARAZO H, Karol, MENDOZA F, Cristina y CARRERO S, Rocío.(2008). Effect of plant extracts of Polygonum hydropiperoides, Solanum nigrum and Calliandra pittieri in Spodoptera frugiperda. Agronomia Colombiana Vol. 26, No. 3, pp. 427-434.
NICHOLLS, E CI. (2014). Control biológico de insectos: Un enfoque agroecológico. s.l. : Universidad de Antioquía, pp. 2-124.
ORTIZ, F. (2010). Diccionario de especialidades agroquímicas.Thompson. PLM.del Ecuador S.A. Quito : Ecuador. p. 310.
SOSA, M y VITTI, D. (2005). Captura de adultos del gusano cogollero (Spodoptera frugiperda Smith) en trampas de luz. s.l.: INTA, p. 20.
VAZQUEZ MORENO, Luis. (2003). Manejo Integrado de Plagas. Preguntas y respuestas para extensionistas y agricultores IDISAV INISAV. La Habana: INISAV, p. 566.