ESTRATEGIA DE DESARROLLO REGIONAL SUSTENTABLE EN EL CULTIVO in vitro DE VAINILLA (Vanilla planifolia)
SUSTAINABLE REGIONAL DEVELOPMENT STRATEGY IN VANILLA (Vanilla planifolia) in vitro cultivation
Autores: Juan Luis Moreno Méndez1
Aarón Comunidad Villa1
Víctor Manuel Chávez Ávila2
Institución: 1Instituto Tecnológico Superior de Zacapoaxtla, México
2Universidad Nacional Autónoma de México, Instituto de Biología. México
Correo electrónico: morenomendezjuanluis@gmail.com
|
Moreno, J.L.; Comunidad, A. & Chávez, V.M. Estrategia de desarrollo regional sustentable en el cultivo… Pág. 89-104 Recibido: 11/05/2021 Aceptado: 20/09/2021 Publicado: 25/11/2021 |
Universidad & Ciencia Vol. 10 (2021) Especial Civitec ISSN: 2227-2690 RNPS: 2450 |
RESUMEN
El Cultivo de Tejidos Vegetales es una herramienta de la biotecnología, que permite la obtención de plantas completas a partir de explantes vegetales, ha demostrado ser una opción eficiente para escalar la producción y la recuperación de especies que se encuentran en peligro de extinción. Por lo tanto, es una alternativa viable para contribuir al aprovechamiento sustentable y conservación de Vanilla planifolia; orquídea endémica de México, la cual se caracteriza por su importancia económica, cultural, ornamental y biológica en Centroamérica.
Durante la investigación se realizó la regeneración in vitro de plantas completas a partir de nudos y hojas; y se evaluó la germinación in vitro de semillas de frutos en distinto estado de madurez. Para ello se establecieron diferentes tratamientos para el cultivo aséptico de explantes somáticos y la germinación en medio de cultivo MS (Murashige y Skoog) modificado al 50 % de sales minerales y compuestos orgánicos.
Como resultado se obtuvo la germinación de las semillas de frutos inmaduros en medio MS 50 % sin RCV a las 18 semanas después de su cultivo. De los nudos, se obtuvieron brotes y posteriormente formación de plántulas, en el medio MS 50/100 con BAP 2.0 mg L-1, se generaron el mayor número de brotes por explante que corresponde a 4, esto de acuerdo con el análisis estadístico realizado en el programa SAS, obteniendo diferencia significativa respecto a los demás tratamientos.
Los resultados obtenidos corroboraron la utilidad del cultivo in vitro como alternativa biotecnológica para la multiplicación y conservación in vitro de vainilla.
Palabras clave: Conservación, Cultivo de tejidos, Germinación, Sustentabilidad.
ABSTRACT
Plant Tissue Culture is a biotechnology tool that allows the obtaining of complete plants from plant explants, it has proven to be an efficient option to scale the production and recovery of species that are in danger of extinction. Therefore, it is a viable alternative to contribute to the sustainable use and conservation of Vanilla planifolia; Endemic orchid of Mexico, which is characterized by its economic, cultural, ornamental and biological importance in Central America.
During the research, the in vitro regeneration of whole plants from nodes and leaves was carried out; and the in vitro germination of fruit seeds in different stages of maturity was evaluated. For this, different treatments were proposed for the aseptic culture of somatic explants and germination in MS culture medium (Murashige and Skoog) modified to 50 % mineral salts and organic compounds.
As a result, the germination of the seeds of immature fruits was obtained in 50 % MS medium at 18 weeks after their cultivation. From the nodes, shoots were obtained and then the formation of seedlings, in the MS 50/100 medium with BAP 2.0 mg L-1, the highest number of shoots per explant were generated, which corresponds to 4, this according to the statistical analysis performed in the SAS program, obtaining a significant difference with respect to the other treatments.
The results obtained corroborated the usefulness of in vitro culture as a biotechnological alternative for the multiplication and in vitro conservation of vanilla.
Key Words: Conservation, Germination, Sustainability, Tissue culture.
INTRODUCCIÓN
Las orquídeas constituyen uno de los grupos más diversos en el territorio mexicano, incluye 1,213 especies descritas, prevaleciendo los estados de Oaxaca, Chiapas y Veracruz en cuanto a mayor diversidad (Villaseñor, 2016, p. 811). Este número continúa incrementándose por las especies aún no identificadas, así mismo se estima que alrededor del 40 % de las orquídeas presentes en el país son endémicas, dentro de esta familia se encuentra una de las especies más conocidas: Vanilla planifolia (Díaz, 2013, p. 8-9).
En el caso particular, Vanilla planifolia es una orquídea nativa de México, teniendo como centro de origen: la zona del Totonacapan, que comprende el norte del estado de Puebla y Veracruz. Esta especie llega a producir unos frutos en forma de vainas, de las cuales se extrae una esencia muy característica, la cual es conocida como vainillina o aldehído vanílico (López, et al., 2014, p. 121). Las proyecciones para el año 2030, estiman un aumento de la demanda mundial de vainilla de 7,307.14 a 10,515 ton y por consiguiente; es indispensable que se busquen alternativas para su rápida producción, no obstante, en el país este cultivo presenta algunos problemas; debido a que se propaga asexualmente mediante esquejes y no por semillas, siendo esta una alternativa común, para la obtención de plantas nuevas, sin embargo, a partir de ello se genera un problema aun mayor, dado que las plantas obtenidas son sencillamente clones de un solo individuo y esto limita la diversificación genética (Sagarpa, 2017, p. 2,4; Serrano, 2018, p. 21,31).
Aunado a lo anterior, esto se puede resolver con la germinación in vitro de semillas y el cultivo in vitro de tejidos vegetales; término utilizado para describir diferentes técnicas de cultivo de células, tejidos u órganos en un medio nutritivo bajo condiciones asépticas y con la capacidad de poder regenerar nuevos individuos completos, los cuales se pueden desarrollar hasta la madurez (Mata et al., 2008, p. 356).
El cultivo de tejidos vegetales es una parte de la biotecnología que hace posible propagar una gran cantidad de plantas a partir de explantes de hojas, raíces, tallos, pétalos, polen, semillas, entre otros. Estos son cultivados en medios nutritivos sintéticos como, por ejemplo; MS (Murashige y Skoog), bajo condiciones controladas de luz, temperatura, pH; para obtener así plantas clonadas en corto tiempo, libres de patógenos (González et al., 2012, p. 5). Así mismo, las técnicas de cultivo in vitro permiten resguardar genotipos nativos valiosos y posibilita la realización de estudios moleculares y genéticos para conocer los factores que afectan el desarrollo de estas especies en su hábitat natural (Pedraza, 2017 p. 32).
Dentro del proceso de cultivo de tejidos vegetales (CTV), es importante aplicar técnicas de asepsia y el uso de reguladores de crecimiento vegetal (González et al., 2012, p. 6). Por lo que refiere a las técnicas de asepsia; estas son aplicadas para prevenir la introducción de hongos, bacterias, virus, micoplasma u otros organismos a los cultivos de células, tejidos y órganos. También son fundamentales para prevenir contaminación microbiana (Uribe et al., 2008, p. 58,59).
En este sentido, la conservación ex situ y el almacenamiento del germoplasma mediante el cultivo de tejidos vegetales, son indispensables en los programas de conservación (Tejeda et al., p. 3,5). Desde este enfoque, la aplicación de técnicas de cultivo in vitro es fundamental para el aprovechamiento sustentable de los recursos naturales; haciendo énfasis en satisfacer las necesidades de la generación actual sin comprometer los recursos naturales y la posibilidad de las futuras generaciones para cubrir sus propias necesidades (Contreras, 2008, p. 197).
Es importante mencionar que, el presente estudio tuvo como propósito lograr la propagación de Vanilla planifolia mediante la regeneración de plántulas a partir de explantes de nudos y la germinación de semillas maduras, medianamente maduras e inmaduras; bajo diferentes concentraciones de reguladores de crecimiento vegetal y aplicando los conocimientos de cultivo de tejidos vegetales.
MATERIALES Y MÉTODOS
Material biológico
Como material biológico para esta investigación, se emplearon semillas de vainas en tres estados de madurez procedentes del municipio de Cuetzalan del Progreso, Puebla, México; y plántulas de Vanilla planifolia cultivadas in vitro en el Laboratorio de Cultivo de Tejidos Vegetales del Jardín Botánico del Instituto de Biología, UNAM.
Semillas
Las cinco vainas de Vanilla planifolia, fueron adquiridas durante el mes de agosto del año 2019 a productores del municipio de Cuetzalan del Progreso, Puebla; 2 vainas, tenían un estado de desarrollo avanzado (Maduras); 2 en estado de madurez medio (Parcialmente Maduras) y 1 vaina verde (Inmadura); cosechadas a los 3, 6 y 9 meses después de la polinización respectivamente.
A todas las cápsulas les fueron tomadas distintas medidas morfométricas con la ayuda de una regla y vernier; mientras que para el caso de las semillas se realizó una medición a escala mediante fotografía (Figura 1).
Nudos y hojas
Se emplearon plántulas de Vanilla planifolia cultivadas in vitro como fuente del material biológico, utilizando para ello nudos y hojas, las plántulas fueron proporcionadas por el Laboratorio de Cultivo de Tejidos Vegetales del Jardín botánico, IB-UNAM.
Preparación de Medios de cultivo MS 50 %
Para la germinación y cultivo in vitro de todo material biológico, correspondiente a semillas, nudos y hojas); se utilizó el medio nutritivo MS (Murashige y Skoog, 1962) modificado con 50 % de la concentración de compuestos inorgánicos y 100 % de la concentración de compuestos orgánicos (MS 50/100), como fuente de carbono se emplearon 30 mg L-1 de sacarosa. El pH fue ajustado a 5.7 empleando NaOH ó HCl, posteriormente se adicionó el gelificante Gellan gum 4 g L-1), se agitó, disolvió y calentó en un horno de microondas hasta que alcanzó su punto de ebullición, enseguida se colocó el medio en una parrilla de agitación magnética, para homogenizar el medio de cultivo. Este proceso se realizó al menos en 3 ocasiones, para asegurar la disolución del gelificante y obtener la homogenización de la solución.
Para el cultivo de semillas se prepararon 4 litros de medio MS 50 %: 2 litros sin Regulador de Crecimiento Vegetal (RCV) y 2 litros con ácido giberélico (GA3) en concentración de 1 mg L-1.
Los medios de cultivos preparados fueron vertidos en cajas de petri; las cuales fueron previamente esterilizadas en estuches de acero inoxidable y bajo condiciones asépticas. El medio de cultivo esterilizado fue repartido, 15 ml aproximadamente en cada caja de petri; se dejaron enfriar para que gelificaran. Por otra parte, la otra mitad del medio preparado fue vertido en los frascos de vidrio, colocando en cada uno de ellos 25 ml (Tabla 1).
Tabla 1: Tratamientos aplicados para la germinación de las semillas de Vanilla planifolia.
|
Contenedor |
Semillas inmaduras |
Semillas madurez medio |
Semillas maduras |
|||
|
Cajas de Petri |
S.H. |
A.G. |
S.H. |
A.G. |
S.H. |
A.G. |
|
Frascos |
S.H. |
A.G. |
S.H. |
A.G. |
S.H. |
A.G. |
|
En total se emplearon 12 tratamientos, con tres repeticiones cada una. S.H: Sin Hormona A.G: Acido Giberelico (1 mg L-1). |
||||||
Desinfección de Semillas de Cápsulas Maduras y Parcialmente Maduras
Los frutos abiertos presentaban antesis, las semillas se extrajeron y, bajo condiciones de asepsia en una campana de flujo laminar se pasaron a una caja Petri, la cual contenía una solución de hipoclorito de sodio (NaOCl) 20 % v/v con agua destilada estéril, se mantuvo en agitación constante durante 25 minutos. Una vez transcurrido este tiempo, se realizaron 3 enjuagues con agua destilada esterilizada. Finalmente, las semillas se sembraron tratando de esparcirlas homogéneamente en el medio de cultivo MS 50 %, dentro de los frascos o cajas de Petri 10 contenedores por cada tratamiento.
Semillas de Cápsula Inmadura
La manipulación de la cápsula inmadura se llevó directo en una campana de flujo laminar en condiciones asépticas, fue flameada 3 veces, previas inmersiones en alcohol etílico al 96 %, posteriormente se colocó en una caja petri, para hacer un corte transversal seguido de cortes longitudinales para extraer las semillas con una espátula. Para el proceso de siembra se acomodaron uniformemente 10 frascos de vidrio por repetición y 10 cajas Petri por replica, con el medio de cultivo MS 50 %
Nudos y Hojas
A partir de plántulas de 5-10 cm altura de V. planifolia, cultivadas in vitro del Laboratorio de Cultivo de Tejidos Vegetales de donde se obtuvieron las secciones de tallo (nudos) y hojas inmaduras. Bajo condiciones asépticas en una caja Petri fueron disectados (individualizados) nudos y hojas, los cuales fueron sembrados en medio MS 50% en frascos de vidrio con las siguientes concentraciones de reguladores de crecimiento vegetal (Tabla 2 y 3); de cada tratamiento fueron preparados 100ml de medio de cultivo y distribuidos en 21 frascos por cada tratamiento.
Tabla 2: Tratamientos aplicados para la inducción del desarrollo de estructuras a partir de yemas (nudos y ápices) de Vanilla planifolia.
|
N. tratamientos |
6-Bencilaminopurina (mg L-1) |
2iP (mg L-1) |
|
1 |
0 |
0 |
|
2 |
2.0 |
0 |
|
3 |
0.25 |
0 |
|
4 |
0 |
0.20 |
|
Las yemas inducidas (4 nudos o ápices/ frasco); por un periodo inicial en presencia de los RCV, de 35 días. - 4 en total tratamientos, con tres repeticiones cada una |
||
Tabla 3: Tratamientos aplicados para la inducción del desarrollo de estructuras a partir de hojas de Vanilla planifolia.
|
N. Tratamientos |
2,4-D (mg L-1) |
Picloram (mg L-1) |
|
1 |
0 |
0 |
|
2 |
0.25 |
0 |
|
3 |
0.50 |
0 |
|
4 |
0 |
0.10 |
|
5 |
0 |
0.25 |
|
Se sembraron hojas (de 1 cm2) de las cuales se sembraron 4 en cada frasco, 2 con el haz en contacto con el medio de cultivo y 2 con el envés en contacto con el medio de cultivo. - 5 tratamientos en total, con tres repeticiones cada una. |
||
Todos los medios de cultivo fueron esterilizados en autoclave a 120°C, a 1.5Kg/cm2, durante 20 minutos; además el agua utilizada y distintos materiales de cristalería fueron autoclaveados a 25 minutos. Todos los cultivos de semillas, tallos u hojas tanto en frascos y cajas de Petri fueron incubados bajo condiciones controladas del laboratorio con un fotoperiodo de 16 h luz y 8 h de oscuridad, a 25 ±2°C.
Evaluación y análisis. Los resultados obtenidos respecto a tiempo de germinación de semillas para los distintos cultivos; se desarrolló a distintos tiempos del número y tamaño de brotes, raíces, plántulas; cantidad de los brotes en explantes cultivados (coloración y forma de las estructuras formadas) fueron evaluados mediante un análisis de varianza y la aplicación de la prueba de Tukey (p≤0.05), utilizando el paquete de análisis estadístico SAS System para Windows 9.0.
RESULTADOS Y DISCUSIÓN
Medición morfométrica de las vainas
Las vainas obtenidas a través de los productores del municipio de Cuetzalan del Progreso, Puebla fueron 5 en total, las cuales se clasificaron de acuerdo con el estado de madurez que presentaban: 2 vainas totalmente maduras de 9 meses después de su polinización; 2 vainas medianamente maduras de 6 meses después de su polinización y finalmente una vaina inmadura de 3 meses posterior a su polinización (Tabla 4). En el trabajo realizado por Serrano (2018) se utilizaron vainas de 270 días después de la polinización con medidas aproximadas a poco más de 18 cm de largo, mientras que Menchaca et al., (2011) emplearon vainas cortadas a los 44 días después de la polinización, por otra parte, Flores et al., (2017) seleccionaron 3 cápsulas de 4 cm, 9 a 10 cm y de 15 a 18 cm respectivamente y con un grosor de 0.5 a 1 cm y todas de coloración verde intenso, sin importar la diferencia de tamaño.
Tabla 4: Dimensiones morfométricas de las vainas de V. planifolia.
|
Medición morfométrica de las capsulas de Vanilla planifolia |
|
|
Vainas maduras |
Dimensiones (cm) |
|
Largo total |
15.6 cm |
|
Ancho: Basal |
0.5 cm |
|
Ancho: Media |
1.0 cm |
|
Ancho: Apical |
1.2 cm |
|
Vainas parcialmente maduras |
Dimensiones (cm) |
|
Largo total |
18 cm |
|
Ancho: Basal |
0.8 cm |
|
Ancho: Media |
1.2 cm |
|
Ancho: Apical |
1.2 cm |
|
Vaina inmadura |
Dimensiones (cm) |
|
Largo total |
22.1 cm |
|
Ancho: Basal |
1.0 cm |
|
Ancho: Media |
1.4 cm |
|
Ancho: Apical |
1.5 cm |
|
Maduras (9 meses después de la polinización); medianamente maduras (6 meses después de la polinización) e inmaduras (3 meses después de la polinización). |
|

Figura. 1: Medición morfométrica de la vaina inmadura.
a) Medición de la parte apical de la vaina b) medición de la parte media c) medición de la parte basal d) medición longitudinal de la vaina.
Desinfección de material biológico
Semillas maduras y medianamente inmaduras: La desinfección de las semillas de ambos estados de madurez tuvo variación en la efectividad; los frascos y cajas con semillas obtenidas de las vainas maduras tuvieron un 30 % de contaminación. Mientras que los frascos y cajas de Petri con semillas obtenidas de vainas inmaduras presentaron el 40 % de contaminación. Con respecto a las semillas inmaduras la aplicación de hipoclorito de sodio ocasiono la liberación de una sustancia de color café en el medio de cultivo, sin embargo, se descartó contaminación y se le atribuyó a una liberación de algún pigmento. En este caso se encontraron diversos estudios con métodos de desinfección en semillas de orquídeas como el realizado por Villafuerte (2013), Carmona (2016) y Serrano (2018) este último con V. planifolia en donde se logró una desinfección total de las semillas, dichos estudios emplearon una metodología similar a la establecida para esta investigación; usando hipoclorito de sodio y alcohol en diferentes concentraciones.
Semillas totalmente inmaduras: Las semillas inmaduras que fueron cultivadas no tuvieron contaminación alguna y el método de desinfección utilizado fue totalmente exitoso, la esterilidad se le atribuyó a que el fruto estaba totalmente cerrado y en el interior las semillas se mantuvieron asépticas. Lo cual coincide con los estudios de Menchaca et al., (2011); Flores et al., (2017), en el que se utilizó flameo con alcohol al 96 % en dos repeticiones.
Secciones de nudos y hojas: No se utilizó ningún método de desinfección para dichos explantes. Y por consiguiente se mostró un porcentaje de contaminación del 40 % en nudos, sin embargo, no se observó contaminación en las secciones de hojas.
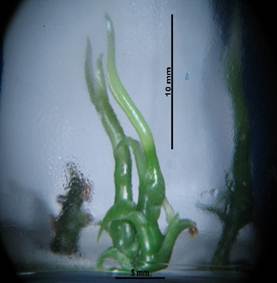
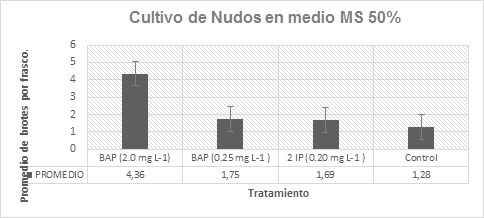
Formación de brotes
La respuesta a la formación de los brotes obtenidos por explante indica que el tratamiento con mayor desarrollo y número de brotes logrados (Tabla 5), fue el medio MS 50/100 adicionado con BAP 2.0 mg L-1, debido a que se obtuvo un promedio de 4.36 brotes por explante (ilustración 2 y 3), seguido por el medio MS 50/100 adicionado con BAP a una concentración de 0.25 mg L-1 con 1.75 brotes por explante (ilustración 8 y 9), se obtuvo en el mismo medio pero con la concentración de 0.2 mg L-1 de 2IP logro formar 1.69 brotes por explante (ilustración 6 y 7) y finalmente el testigo en donde se obtuvieron 1.28 brotes por explante (ilustración 4 y 5). De esta manera y de acuerdo con el análisis de varianza y prueba de Tukey (p≤0.05): el tratamiento con BAP 2.0 mg L-1 influyó significativamente en el desarrollo de brotes por explantes cultivado (Gráfico 1). Resultados similares han sido reportados en vainilla por Serrano (2018,) al obtener 4.8 botes por explante al emplear ANA/BAP a una concentración de 0.5/1 mg L-1. En contraste (Lee et al., (2008), lograron obtener en promedio 11 brotes por explante en yemas maduras, empleando 2.0 mg L-1 de BAP, en medio de cultivo MS.
Por otra parte, Rodríguez et al., (2014) obtuvieron como número de brotes 2.24 empleando el sistema de inmersión con medio MS líquido al 80 % del contenido de sales, suplementado con BAP, por 45 días.